-
血液循环系统影响到人体的各个方面,对人体的生命健康至关重要,因此,血流测量在临床医疗等方面具有很高的价值[1]。例如激光多普勒血流仪可以监测肿瘤微循环指标[2],辅助医生治疗,而对烧伤部位的毛细血管研究也是血液循环检测研究的重要方向[3],它更是可以应用在人体激光手术和用药恢复情况的检查上[4]。由此人体血液循环的检测不仅能够诊断人体是否患病[5],也能帮助人体康复。
临床反馈有些症状的病人,虽然血压、脉搏等生理参数保持在正常范围,但体内血流速度已经脱离安全范围[6-7],病人实际上是处于危险之中的,如果能够像血压、脉搏等生理参数一样实现对血流速度的实时监控,就具有重要意义。此外,光学相干层析技术可以显示视网膜结构与血管信息,光声多普勒技术可以对人体组织的内部结构和功能成像,能够帮助临床医生进行更加精确的诊断。
近年来,光学多普勒血流测量技术[8]在临床医学方面的发展令人瞩目,表现出了许多的优点。首先光学多普勒血流测量技术是一种无创血流测量技术[9],它无需破坏人体表皮,避免病人因为破损而引起的感染问题,这一点对于患有血友病之类特殊病症的患者来说十分重要;也无需涂抹特殊的介质辅助测量,对例如烧伤组织[10-12]或视网膜[13-15]等部位的血流检测更有利。另外,激光的频率远高于声学的频率值,因此光学的多普勒测量技术能够获得更大的多普勒频移,能够排除大部分由周围组织器官所产生的低频杂波信号,极大地提高了测量的精确度。激光速度和光电探测器的灵敏度都较高,实时性更高,对于监测病人的状况具有更高的效率,适用性更好。
但其也存在着一定的局限性,例如激光多普勒因为组织对光的吸收而难以推测较深入的组织血流信息,或是光学相干层析技术的扫描速度和分辨率还不足以完全做到实时成像,以及光声成像的纳米探针的生物毒性还有待检测。
光学无创血流测量技术根据工作原理的不同分为3大类,按照发展时间的先后分别为:激光多普勒血流测量技术、光学相干层析多普勒成像技术、光声多普勒血流测量技术。本文中主要概述了这3种光学无创血流测量技术的发展历程及其最新进展,并对其未来前景与应用进行了展望。
-
光具有波的性质,因此也具有与声学相似的光学多普勒效应,即如果出射光源与光电探测器存在相对运动,光电探测器接收到的散射光光频率存在多普勒频移,频移的值取决于相向运动速率[16]。如图 1所示,P表示随流体一起运动且运动速率为vn的微粒,θ是激光与接收器之间的夹角,V表示散射光方向,ϕ是运动方向与散射光夹角。
频率f、波长λ与波速c的关系见下式:
$ f = c/\lambda $
(1) 当光源与接收器的相对速率为vn,入射夹角为θ时,多普勒频移Δf见下式[17]:
$ {\rm{\Delta }}f = \frac{{2{v_{\rm{n}}}\sin (\theta /2)}}{\lambda } $
(2) 在已知入射波长和入射夹角的情况下,通过光电探测器测量散射光的多普勒频移即可得到相对速率vn。目前,常使用快速傅里叶变换(fast Fourier transform,FFT)变换和小波变换(wavelet transform,WT)等技术对信号去噪,提升信号精确度[18-20]。
1964年,哥伦比亚大学学者基于光学多普勒效应的测速技术,利用632 nm的He-Ne激光器和光电倍增管搭建系统,测量了玻璃管中液体的流动速度的大小,通过声光移频器测定流体的速度方向,能够测量最低为0.07 mm/s的流速[21]。1972年,RIVA等人基于光学多普勒效应的测速技术对兔子的视网膜动脉血管血液流速进行了检测,其基本原理是利用激光入射到相对运动中的血红细胞上所产生的多普勒频移,从多普勒频移信号之中提取出血流的速度信息[22]。3年后,基于光学多普勒效应的血液微循环检测研究最先由STERN提出[23]。1981年,BONNER和NOSSAL通过数学物理建模,发现多普勒频移的大小与血液浓度和流量密切相关,而与血液流动方向无关,对激光多普勒血流测量技术进行了详细解释[24],至此奠定了激光多普勒无创血流测量技术的基础。1984年,ALSBJÖRN等人将激光多普勒血流测量技术应用到了患者烧伤部位的检测上,检测效果良好[25]。2001年,DROOG等人改进了多普勒血流检测技术,能够对目标组织进行范围性的血流灌注成像,为临床检查烧伤患者提供了新思路,有助于技术进步[26]。2015年,KYODEN等人提出了一种横断面多点激光多普勒测量(laser Doppler velocimetry,LDV)系统[27],采用线性排列的多通道同时测量和采用网格模式排列的多通道同时测量这两种方法,成功地对小鼠肠系膜内的血流进行了2维速度测量,体现了该系统方法在外科手术中的应用前景。工作原理如图 2所示,获得结果如图 3所示。图中,L-MLDV(linear multiple-point LDV)是线性多点LDV系统,APD(avalanche photo diode)是雪崩光电二极管。
-
目前的激光多普勒血流仪主要分为两类,一种是以光纤为主的单点或多点探测,另一种是利用互补金属氧化物半导体(complementary metal-oxide-semiconductor,CMOS)相机进行激光扫描宽场成像。后者在2002年由ARILDSSON等人提出,是一种基于CMOS快速相机的激光多普勒宽场实时成像技术,其利用CMOS成像系统克服了激光多普勒血流成像仪以低强度激光束通过移动镜、以光栅方式扫描组织表面但无法实时测量的困难,相比当时的机械激光多普勒灌注成像[28],它能够显示出多普勒信号的大小,但没有成功提取出信号频率的大小[29]。该技术的原理结构如图 4所示[30]。图中,I/O(input/output)表示输入/输出,ADC(analog-to-digital converter)表示模数转换器,CPU(central processing unit)表示中央处理器,RAM(random access memory)表示随机存取存储器,HDD(hard disk drive)表示机械硬盘。激光光源出射激光经过扩束镜均匀地照射到组织上,基于组织细胞对于近红外光的散射特性,一般使用红色或近红外的激光,使用CMOS相机获取激光多普勒信号,在经过A/D转换之后得到数字图像,并将其送入到计算机中进行数字信号处理得到组织的血灌注分布图像如图 5所示[31]。
2013年,HE等人设计并提出了一种片上信号处理的全集成2维CMOS血流传感器[32],具有64 pixel×64 pixel的空间效率。该传感器成功地把模拟和数字处理电路集成在了一个芯片上,克服了探测器和处理电子设备之间存在的数据瓶颈,重新设计如图 6所示,其成像系统整体的帧率基本能做到1帧/s,与仿真结果一致。图中,SF(source follower)表示源跟随器,HDA(hysteretic differentiator amplifier)表示迟滞微分放大器,GMC是德国生产的一种跨导电容低通滤波器。
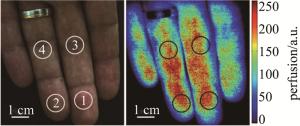
国内对于激光宽场多普勒的研究也在逐渐进步。2017年,电子科技大学的WANG构建了一套全新的测试系统,采用了自制的高速采样设备,对人体的手指、手心、手背进行了血流流速成像,实验结果见图 7[33]。
-
光学相干层析(optical coherence tomography,OCT)技术最早于1991年提出,美国的HUANG等人最先采用光学相干层析成像技术,并应用于人体视网膜和冠状动脉壁成像[34]。1993年,FERCHER等人提出了利用低相干光学干涉技术可以获得生物系统之中的体外层析图像,并且将这种光学断层扫描技术应用于眼部组织,即OCT成像技术[35]。
激光宽场多普勒测血流技术的优点在于能够对大面积的组织表面进行成像,但其空间分辨率不高,连小动脉都难以分辨,而OCT技术则突破了这种限制。OCT是一种基于低相干光干涉特性的成像技术,具有高分辨率、无需损伤人体、可跨层成像、高灵敏度、实时成像的优良性能,在眼科、心血管、皮肤等方面发展迅速。因为眼部具有和透明介质相近的性质,光可以穿过眼前节而照射到视网膜等部位,所以OCT技术在眼科成像的领域快速发展[36],如使用OCT血管造影(optical coherence tomography angiograhpy,OCTA)技术对弱视[37]、青光眼[38-39]、黄斑[40]乃至新冠患者后遗症[41-43]的视网膜血管检测,例如开角型青光眼的血管密度异常[44],或是提示高血流信号从而预测视网膜动脉瘤的发生等[45]。
光学相干层析血管造影是傅里叶域OCT(Fourier domain OCT,FD-OCT)在生物血管成像上的应用。它针对OCT在生物组织中无法分辨血流的问题,根据血红细胞的运动导致背散射光信号不稳定,而在静态组织中背散射光稳定的特点,将FD-OCT收集的信号结合算法完成对组织的血流成像。
OCT系统的原理如图 8所示。迈克尔逊干涉仪是它的核心,光源的出射光经过4段光纤耦合器分为两束,分别作为参考光入射到反射镜和作为入射光入射到样品。由参考镜返回的参考光与样品返回的散射光在光纤耦合器中发生干涉。由于散射光来自于样品的各个深度,具有不同的相位差,通过改变参考光和散射光的光程差,让其在一个相干长度内,参考光和散射光才会产生干涉现象,得到样品的纵向结构信息,同时将参考臂进行横向扫描,再将得到的信号经过计算机结合图像算法处理,根据测得信号的强弱返回对应的色彩即可得到断层扫描图和3维结构图[46]。
一般OCT有两种扫描方式: 轴向扫描方式(A扫描方式)和横向扫描方式(B扫描方式)。A扫描方式通过轴向移动,能够得到组织探测深度的信息;B扫描方式是在进行连续A扫描时,移动样品臂,使探测光束扫过整个组织表面,进而得到组织背景散射的横截面图。
多普勒OCT(Doppler optical coherence tomography,DOCT)是一种基于相位的OCT-A算法,其利用多普勒效应进行工作。入射光由于血红细胞的运动而产生多普勒效应,进而引起波的频率和干涉条纹相位产生变化,且由于结合了相位项,DOCT不仅能够进行血管成像,还能对血流进行测速,检测血管的直径等等,常用于对视网膜病变的检测。
时域OCT求血流速率v的公式如下:
$ v = {\rm{\Delta }}\varphi {v_A}{\lambda _0}/(4\pi n\cos \theta ) $
(3) 式中,Δφ为滑动窗口相位变化的均值,λ0为入射光中心波长,vA为OCT-A的扫描速率,n为扫描血管处的折射率,θ为采样光的夹角。
在实际应用中,WANG等医生提出了使用OCT-A技术对视网膜静脉阻塞患者的患病眼与健康眼进行测量对比,得出两者表层视网膜凹无血管区面积及深层视网膜血流密度差异明显等结果,由此可知OCT-A技术的检查能够帮助诊断视网膜静脉阻塞患者黄斑区视网膜的微循环阻塞等方面[47]。同样ZHONG等人将原发性青光眼患者与正常人进行OCT-A的对比检测,发现OCT-A测得的黄斑区血管密度﹑黄斑视网膜神经节细胞层厚度﹑黄斑全层厚度与视野平均缺损值均呈线性正相关,证明OCT-A技术对青光眼诊断具有较大的实际价值[48]。国外的SAKAI等人使用新型的DOCT流量计测量了视网膜的微动脉脉冲波形,得到的结果具有良好的重复性和再现性,有助于对人体循环的检测研究[49]。
此外,KISELEVA等人提出将多模式结合的OCT技术应用于急性肠系膜缺血患者术中检测小肠壁微观结构及微循环,该技术能够显示浆膜层等部位的血管损伤程度,如图 9所示。证明多模式OCT在急诊手术中的有效性[50]。从图 9b可以看出,血管系统已明显稀疏,在某些区域,微血管形成的背景已消失。图中,1表示壁内血管,2表示微血管的光背景。
同时,OCT技术还存在需要突破的地方,例如目前临床使用的商用血管内OCT只能达到约100 kHz的线速度,160 frame/s~180 frame/s的帧速度,40 mm/s的回撤速度,在1次的回撤成像(50 mm~70 mm)中会受到2~3次的心跳影响,造成3维OCT图像的扭曲模糊。现阶段的临床OCT大多采用的是1300 nm中心波长、约100 nm带宽的光源,其轴向分辨率约15 μm,其圆周分辨率在焦点处仅有约30 μm,难以识别细胞及亚细胞尺寸的形态结构等。通过对高速OCT以及多模式结合OCT等研究,OCT有望实现真正的实时3维成像,提高其对临床医学的帮助与价值[51]。
-
光声效应是指物体吸收光照的能量,物体的能量温度发生与光相同频率的改变,进而产生与入射光相同频率的光声信号。而在光源和物体存在相对运动时,接收器接收到的光声信号的频率和入射光的频率存在一定程度上的频移,即为光声多普勒频移。
光声成像(photoacoustic imaging,PAI)是基于生物组织光声效应的一种新兴成像技术。在光声效应中,物体吸收光照能量转换为热能并膨胀,产生携带多普勒频移的光声信号,如图 10所示[52]。在这个过程中有两次多普勒频移,其中Ko表示光的照明方向,Ka表示产生的光声信号,v表示光吸收颗粒运动的速率,α和θ为矢量之间的夹角[53]。
所以光声多普勒(photoacoustic Doppler,PAD)频移公式可以表示为:
$ {f_{{\rm{PAD}}}} = - {f_{\rm{a}}}v\cos \alpha /{c_0} + {f_{\rm{o}}}v\cos \theta /{c_{\rm{a}}} $
(4) 式中,fo为入射光的频率,c0和ca分别为光子密度波波速和超声波波速;fovcosα/c0表示将粒子视为运动探测器接收到的光波频移,fovcosθ/ca表示超声换能器接收到光声信号的偏移值。
由于c0和ca远大于吸收颗粒的运动速率v,且c0/ca≈105,由此可将fovcosα/c0忽略,得:
$ {f_{{\rm{PAD}}}} = {f_{\rm{a}}}v\cos \theta /{c_{\rm{a}}} $
(5) 这个位移等于脉冲回波多普勒超声偏移量的一半,与入射光方向无关。由此若θ固定,fPAD与ca成反比,可以通过求光声多普勒频移的大小而得到运动速率v,所以公式为:
$ v = {f_{{\rm{PAD}}}}{c_{\rm{a}}}/\left( {{f_{\rm{o}}}\cos \theta } \right) $
(6) 该项技术在医疗领域具有广阔的前景,广泛应用于心血管疾病和癌症肿瘤的检测上[54-55]。
虽然与其它光学无创血流测量技术原理不同,但是光声多普勒成像技术本质上还是基于人体运动红细胞对于光的散射特性,都是通过检测多普勒频移获取信息。它同时具有超声(ultrasound,US)成像的高分辨率以及光学成像的高对比度,相比于激光宽场多普勒技术和光学相干层析多普勒技术,能够对更深的组织实现成像。
光声成像技术的发展始于光声效应的发现。1880年,BELL发现用调频光照射物体会产生等频率的声信号,由此发现了光声效应[56]。2010年,SHEINFELD等人提出了一种新的基于光声多普勒效应的流量测量技术[57]。
目前的光声成像技术主要分为无标记PAI和有标记PAI。光声成像技术能够检测生物的血红蛋白以及氧饱和,对临床医学具有重要意义。无标记PAI具有无需标记物、非接触性强、对特定患者友好等特点,但也存在受杂波信号干扰大、激发源信号衰弱太快、对组织的穿透性低等等问题。因此需要研究有标记PAI,利用如光声探针等标记物增强光声信号,有利于扩展光声成像在医学领域的应用范围[58]。
2015年,VALLURU等人开发了一种基于亚甲基蓝染料积累的双模态光声和超声成像系统对乳腺癌的诊断和治疗提供了帮助,实验结果如图 11所示[59]。
2016年,MIAO等人开发了具有放大信号的激活超小型半导体低聚物纳米探针,有助于放大体内pH的光声成像信号,推进了无创测量活体动物pH值的研究[60]。2019年,DENG等人设计了一种新型光声探针,能够识别肝癌细胞膜上的磷脂酰肌醇蛋白聚糖,分辨肝癌和小结节型的肝硬化,能对肝癌进行早期准确诊断[61]。
光声成像技术在国内也是一个研究热点。2011年,ZHANG等人对光声成像技术的最新进展做了一个讨论,认为多模式组合的光声成像技术,例如US和PAI、PAI和OCT的组合等,是将来的研究方向[62]。2018年,华南师范大学的QIAO等人通过将PAI与多普勒带宽展宽方法结合,设计了一款新型PAI流速仪,没有使用标记物和介质,完成了对血液的测量,扩展了PAI流速测量的应用范围[63],实验结果见图 12。
2021年,中国科学技术大学的YANG等人从3个方向对光声成像技术开展研究:设计一种集成前端放大电路的超声换能器,提高光声成像的灵敏度和成像深度;开发一种高灵敏光声显微成像系统,提高成像分辨率;提出一种基于复合正则反卷积的光声图像增强算法,抑制噪声,提高了成像图像的质量[64]。
如今标记PAI方面的研究已经取得了巨大的进步,但也还存在一部分的问题。首先,一些光声探针在收到激光脉冲时,荧光现象会消耗部分能量,能量没有完全转化为光声信号,降低了接收到的光声信号强度,所以在研究中应该注意削弱这些现象。此外,虽然不少实验证明了光声探针在短期内不存在毒性问题,但是很多的光声探针并不能在生物体内自行分解,也不能保证其长时间在生物体内存在是否产生毒性,故而可降解光声探针将会是光声成像领域的一个未来的发展方向。综上所述,具有许多优良特性的光声探针拥有广阔的未来市场,但是其在临床使用前还是有很长的路要走[65]。
-
光学相比于声学技术来说,具有动态和实时的特性,有望成为未来医学检测血流的主流手段,在生物医疗领域内具有巨大的前景[66]。它也逐渐成为近年的研究热点,对眼科、口腔、心脑血管疾病、临床药物反应等方面的监测[67-73]存在着极大应用前景,推动光学无创血流测量技术发展对于临床医学乃至技术产品产业化都具有极大的价值与意义。
虽然我国对于光学无创血流测量技术已经有了一定程度上的研究和发展,与外国的先进水平相比还要解决一些问题。例如大部分的光学测血流仪器的体积都不小,在运输、安装、调整方面都不方便,此外因为人体内部对光的吸收、组织噪声以及环境噪声干扰等原因,并不能进行非常深的组织探测,扫描速率不够导致不能实时成像等,但随着光学测血流技术和制造技术的不断发展,基于微机电和纳光机电的新型光学多普勒无创测血流设备将在体积、性能上有极大的提高和进步,同时,激光光源的更新换代、纳米探针的改进、噪声和信号的算法提升等,这些问题最终都会得到解决。
-
上述的多种光学多普勒无创血流测量技术各有优缺点,可以运用在不同的场合。激光多普勒宽场测量技术能够应用在较大面积的组织血液灌注的实时观测中,光学相干层析成像技术则更适用于对浅层微细血管的血液流动状况监测;而光声多普勒血流测量技术对于较深层次的组织血流探测显得更具优势。
例如光学相干层析多普勒测血流技术常应用于视网膜等部位的微细血管血液检测[74],中国科学院PAN等人将OCT技术与PAI技术结合起来,构成双模式成像,能够测量血流的绝对速度和角度[75]。SABIONI等人将激光多普勒灌注监测技术运用在新冠病毒患者身上,检测患者的血清细胞因子和趋化因子,发现这些细胞因子与趋化因子参与了血管功能和炎症调节,对消灭新冠病毒具有一定的意义[76]。
虽然光学多普勒技术在测量精度、产品集成化、测量深度等方面还有一定的局限性,但是这些都可以通过技术的发展优化而得到克服,使得光学多普勒技术能在临床医学以及其它工程领域发挥更大的作用。
光学多普勒无创血流测量技术的发展与现状
Development and status of optical Doppler noninvasive blood flow measurement technology
-
摘要: 基于光学多普勒效应的无创血流测量技术具有实时性、无需介质、非侵入式等性质,在临床医疗等领域存在着极大价值与应用前景。目前光学无创血流测量技术主要有激光多普勒血流测量技术、光学相干层析多普勒成像技术和光声多普勒血流测量技术。对这3种技术进行了原理分析,简述了其研究现状,并对这些新型技术的未来和发展进行了展望。Abstract: Due to the properties of real-time, medium-free, and non-invasive, the optical Doppler effect based non-invasive blood flow measurement is valuable and has a promising future in clinical and other fields. At present, there are three optical non-invasive blood flow measurement technologies: laser Doppler blood flow measurement technology, optical coherence tomography Doppler imaging technology, and photo-acoustic Doppler blood flow measurement technology. The principles of the above three technologies were briefly analyzed, the respective development status was described, and the future and development of these new technologies were exhibited.
-
图 7 血液相对流速成像误差消除实验[33]
a—白板相对流速图 b—手指血液相对流速图 c—消除误差后的手指血液相对流速图 d—归一化后的手指血液相对流速图
Figure 7. Experiment on eliminating imaging error of blood relative velocity[33]
a—relative velocity diagram of whiteboard b—finger blood relative velocity diagram c—finger blood relative velocity diagram after error elimination d—normalized finger blood relative velocity diagram
图 9 正常和缺血状态下人体小肠的OCTA图像和相应的组织图像[50]
a—正常肠壁中不同直径的血管网 b—无广泛性肠坏死的缺血肠道 c—缺血肠道伴跨壁坏死
Figure 9. OCTA images of the human small intestine in norm and ischemia with the corresponding histology[50]
a—a network of blood vessels of different diameters in the normal intestine wall b—ischemic bowel without extensivenecrosis c—ischemic bowel with transmural necrosis
-
[1] 吴劲松, 陈衔城, 陆栋. 激光多普勒血流测定法[J]. 中国激光医学杂志, 1999, 8(3): 185-187. doi: 10.3969/j.issn.1003-9430.1999.03.017 WU J S, CHEN X Ch, LU D. Laser Doppler flowmetry[J]. Chinese Journal of Laser Medicine & Surgery, 1999, 8(3): 185-187(in Chinese). doi: 10.3969/j.issn.1003-9430.1999.03.017 [2] 杨小杰, 韩建群. 激光多普勒血流仪在肿瘤血管新生研究中的应用[C]//中国微循环学会2014年全国学术会议大会汇编. 苏州: 中国微循环学会, 2014: 51-52. YANG X J, HAN J Q. Application of laser Doppler flowmetry in the study of tumor angiogenesis[C]//Compilation of 2014 National Aca demic Conference of China microcirculation Society. Suzhou, China: Society of Microcirculation, 2014: 51-52. [3] 胡检, 陈武鹏, 李新强, 等. 氦氖激光对烫伤大鼠皮肤生物效应的实验研究[J]. 中国民族民间医药, 2010, 19(13): 75. doi: 10.3969/j.issn.1007-8517.2010.13.056 HU J, CHEN W P, LI X Q, et al. Experimental study on biological effects of He-Ne laser on scalded rat skin[J]. Chinese Journal of Ethnomedicine and Ethnopharmacy, 2010, 19(13): 75(in Chinese). doi: 10.3969/j.issn.1007-8517.2010.13.056 [4] FOLDVARI M, OGUEJIOFOR C J N, WILSON T W, et al. Transcutaneous delivery of prostaglandin E1: in vitro and laser Doppler flowmetry study[J]. Journal of Pharmaceutical Sciences, 1998, 87(6): 721-725. doi: 10.1021/js970425s [5] HOU X, HE X F, ZHANG X Y, et al. Using laser Doppler flowmetry with wavelet analysis to study skin blood flow regulations after cupping therapy[J]. Skin Research and Technology, 2021, 27(3): 393-399. doi: 10.1111/srt.12970 [6] 剡冬冬, 张钲. 冠状动脉慢血流研究新进展[J]. 中国循环杂志, 2019, 34(3): 309-312. doi: 10.3969/j.issn.1000-3614.2019.03.020 YAN D D, ZHANG Zh. New progress in the study of coronary slow flow[J]. Chinese Circulation Journal, 2019, 34(3): 309-312(in Chinese). doi: 10.3969/j.issn.1000-3614.2019.03.020 [7] ELGHAFFAR S A, SHEIKH R A, GAAFAR A, et al. Assessment of risk factors, clinical presentation and angiographic profile of coronary slow flow phenomenon[J]. Journal of Indian College of Cardiology, 2022, 12(1): 19-24. doi: 10.4103/jicc.jicc_6_21 [8] PRESURA C, AKKERMANS A, HEINKS C, et al. Optical blood flow sensor using self-mixing doppler effect: US, WO2006085278A2[P]. 2007-11-28. [9] 常鹏飞. 激光多普勒血流测量及其在神经外科的应用[J]. 国际脑血管病杂志, 1996, 4(2): 95-97. CHANG P F. Laser Doppler blood flow measurement and its application in neurosurgery[J]. International Journal of Cerebrovascular Diseases, 1996, 4(2): 95-97(in Chinese). [10] 黄莺, 邱林, 梅爱莲, 等. 激光多普勒成像对烧伤深度诊断价值的荟萃分析[J]. 中华烧伤杂志, 2017, 33(5): 301-308. doi: 10.3760/cma.j.issn.1009-2587.2017.05.009 HUANG Y, QIU L, MEI A L, et al. Meta analysis of the value of laser Doppler imaging in the diagnosis of burn depth[J]. Chinese Journal of Burns, 2017, 33(5): 301-308(in Chinese). doi: 10.3760/cma.j.issn.1009-2587.2017.05.009 [11] CLAES K E Y, HOEKSEMA H, VYNCKE T, et al. Evidence based burn depth assessment using laser-based technologies: Where do we stand[J]. Journal of Burn Care & Research, 2020, 42(3): 513-525. [12] ZHENG K J, MIDDELKOOP E, STOOP M, et al. Validity of laser speckle contrast imaging for the prediction of burn wound healing potential[J]. Burns, 2021, 48(2): 45-48. [13] TOWNSEND R, CRINGLE S J, MORGAN W H, et al. Confocal laser Doppler flowmeter measurements in a controlled flow environment in an isolated perfused eye[J]. Experimental Eye Research, 2005, 82(1): 65-73. [14] VENKATARAMAN S T, HUDSON C, FISHER J A, et al. Retinal arteriolar and capillary vascular reactivity in response to isoxic hypercapnia[J]. Experimental Eye Research, 2008, 87(6): 535-542. doi: 10.1016/j.exer.2008.08.020 [15] 封东来, 魏东, 李芳, 等. HRF、OCT早期检查及RBP4检测在糖尿病性视网膜病变中的诊断价值[J]. 空军医学杂志, 2019, 35(4): 347-349. FENG D L, WEI D, LI F, et al. Diagnostic value of HRF, OCT and RBP4 in diabetic retinopathy[J]. Medical Journal of Air Force, 2019, 35(4): 347-349(in Chinese). [16] MILLET C, ROUSTIT M, BLAISE S, et al. Comparison between laser speckle contrast imaging and laser Doppler imaging to assess skin blood flow in humans[J]. Microvascular Research, 2011, 82(2): 147-151. doi: 10.1016/j.mvr.2011.06.006 [17] 魏相飞, 胡骏保, 何锐, 等. 大学物理课程应用之多普勒效应测血液流速[J]. 皖西学院学报, 2018, 34(2): 100-104. WEI X F, HU J B, HE R, et al. Measurement of blood velocity by Doppler effect in College Physics Course[J]. Journal of West Anhui University, 2018, 34(2): 100-104(in Chinese). [18] 刘让雷. 激光多普勒测速中信号的分析与处理研究[D]. 青岛: 青岛科技大学, 2018: 43-54. LIU R L. Solid motion motion measurement based on laser Doppler principle[D]. Qingdao: Qingdao University, 2018: 43-54(in Chinese). [19] 赵洪博, 张达, 杨健坤, 等. 小波分层法在激光多普勒测速信号中的应用[J]. 激光技术, 2019, 43(1): 103-108. ZHAO H B, ZHANG D, YANG J K, et al. Application of wavelet layered method for laser Doppler velocimetry signal[J]. Laser Technology, 2019, 43(1): 103-108(in Chinese). [20] 谈渊, 甘学辉, 张东剑, 等. 基于小波去噪的激光多普勒振动信号处理[J]. 激光技术, 2022, 46(1): 129-133. TAN Y, GAN X H, ZHANG D J, et al. Laser Doppler vibration signal processing based on wavelet denoising[J]. Laser Technology, 2022, 46(1): 129-133(in Chinese). [21] DORNHORST A C. Review of medical physiology[J]. Anesthesiology, 2001, 52(2): 959-960. [22] RIVA C, ROSS B, BENEDEK G B. Laser Doppler measurements of blood flow in capillary tubes and lretinal arteries[J]. Investigative Ophthalmology, 1972, 11(11): 936-944. [23] STERN M D. In vivo evaluation of microcirculation by coherent light scattering[J]. Nature, 1975, 254(5495): 56-58. doi: 10.1038/254056a0 [24] BONNER R, NOSSAL R. Model for laser Doppler measurements of blood flow in tissue[J]. Applied Optics, 1981, 20(12): 2097-2107. doi: 10.1364/AO.20.002097 [25] ALSBJÖRN B, MICHEELS J, SØRENSEN B. Laser Doppler flowmetry measurements of superficial dermal, deep dermal and subdermal burns[J]. Scandinavian Journal of Plastic and Reconstructive Surgery, 1984, 18(1): 75-79. doi: 10.3109/02844318409057406 [26] DROOG E J, STEENBERGEN W, SJÖBERG F. Measurement of depth of burns by laser Doppler perfusion imaging[J]. Burns, 2001, 27(6): 561-568. doi: 10.1016/S0305-4179(01)00021-3 [27] KYODEN T, ABE S, ISHIDA H, et al. High-resolution in-situ LDV monitoring system for measuring velocity distribution in blood vessel[J]. Optics Communications, 2015, 353: 122-132. doi: 10.1016/j.optcom.2015.04.075 [28] ARILDSSON M L, NILSSON G E, WARDELL K. Critical design parameters in laser Doppler perfusion imaging[J]. Proceedings of the SPIE, 1996, 2878: 239527. [29] ALEXANDER S, WIENDELT S, FRITS D M. Laser Doppler perfusion imaging with a complimentary metal oxide semiconductor image sensor[J]. Optics Letters, 2002, 27(5): 300-302. doi: 10.1364/OL.27.000300 [30] ALEXANDRE S, THEO L. High-speed laser Doppler perfusion imaging using an integrating CMOS image sensor[J]. Optics Express, 2005, 3(17): 6416-6428. [31] MENNES O A, NETTEN J J V, SLART R H J A, et al. Novel optical techniques for imaging microcirculation in the diabetic foot[J]. Current Pharmaceutical Design, 2018, 24(12): 1304-1316. doi: 10.2174/1381612824666180302141902 [32] HE D W, NGUYEN H, HAYES-GILL B, et al. Laser Doppler blood flow imaging using a CMOS imaging sensor with on-chip signal processing[J]. Sensors, 2013, 13(9): 12632-12647. doi: 10.3390/s130912632 [33] 王刚. 激光宽场多普勒血液流速系统关键技术研究[D]. 成都: 电子科技大学, 2017: 91-105. WANG G. Research on key technologies of laser Doppler blood flow velocity system[D]. Chengdu: University of Electronic Science and Technology of China, 2017: 91-105(in Chinese). [34] HUANG D, SWANSON E A, LIN C P, et al. Optical coherence tomography[J]. Science, 1991, 254(5035): 1178-1181. doi: 10.1126/science.1957169 [35] FERCHER A F, HITZENBERGER C K, DREXLER W, et al. In vivo optical coherence tomography[J]. American Journal of Ophthalmology, 1993, 116(1): 113-114. doi: 10.1016/S0002-9394(14)71762-3 [36] 俞岚筑, 沈玺. 光学相干断层扫描血管成像在眼部疾病诊断中的应用[J]. 上海交通大学学报(医学版), 2018, 38(7): 829-834. doi: 10.3969/j.issn.1674-8115.2018.07.022 YU L Zh, SHEN X. Research progress in diagnosis of eye diseases using optical coherence tomography angiography[J]. Journal of Shanghai Jiaotong University(Medical Science Edition), 2018, 38(7): 829-834(in Chinese). doi: 10.3969/j.issn.1674-8115.2018.07.022 [37] PUJARI A, SALUJA G, CHAWLA R, et al. Optical coherence tomography angiography in amblyopia: A critical update on current understandings and future perspectives[J]. European Journal of Ophthalmology, 2021, 32(3): 1324-1332. [38] KAMALIPOUR A, MOGHIMI S, HOU H, et al. OCT angiography artifacts in glaucoma[J]. Ophthalmology, 2021, 128(10): 1426-1437. doi: 10.1016/j.ophtha.2021.03.036 [39] HU X X, WANG X L, DAI Y, et al. Effect of nimodipine on macular and peripapillary capillary vessel density in patients with normal-tension glaucoma using optical coherence tomography angiography[J]. Current Eye Research, 2021, 46(12): 1-6. [40] 封炎. 基于OCTA的屈光参差性弱视视网膜黄斑部的分析研究[D]. 南昌: 南昌大学, 2021: 22-31. FENG Y. Analysis and study of the macular of retina inanisometropic amblyopia based on OCTA[D]. Nanchang: Nanchang University, 2021: 22-31(in Chinese). [41] SONMEZ H K, POLAT O A, ERKAN G. Inner retinal layer ischemia and vision loss after COVID-19 infection: A case report[J]. Photodiagnosis and Photodynamic Therapy, 2021, 35: 102406. doi: 10.1016/j.pdpdt.2021.102406 [42] BILBAOMALAVÉ V, GONZÁLEZ Z J, MANUEL S D V, et al. Persistent retinal microvascular impairment in COVID-19 bilateral pneumonia at 6-months follow-up assessed by optical coherence tomography angiography[J]. Biomedicines, 2021, 9(5): 502. doi: 10.3390/biomedicines9050502 [43] GUEMES-VILLAHOZ N, BURGOS-BLASCO B, VIDAL-VILLEGAS B, et al. Reduced macular vessel density in COVID-19 patients with and without associated thrombotic events using optical coherence tomography angiography[J]. Graefe's Archive for Clinical and Experimental Ophthalmology, 2021, 259(8): 1-7. [44] 方林, 陈臻, 张希瑞. 光学相干断层扫描血管成像术在早期青光眼诊断中的优势[J]. 中国医疗设备, 2021, 36(11): 150-154. doi: 10.3969/j.issn.1674-1633.2021.11.035 FANG L, CHEN Zh, ZHANG X R. Advantages of optical coherence tomography angiography in early diagnosis of glaucoma[J]. China Medical Devices, 2021, 36(11): 150-154(in Chinese). doi: 10.3969/j.issn.1674-1633.2021.11.035 [45] MIURA M, MURAMATSU D, HONG Y J, et al. Noninvasive vascular imaging of ruptured retinal arterial macroaneurysms by Doppler optical coherence tomography[J]. BMC Ophthalmology, 2015, 15(1): 1-5. doi: 10.1186/1471-2415-15-1 [46] 陆冬筱, 房文汇, 李玉瑶, 等. 光学相干层析成像技术原理及研究进展[J]. 中国光学, 2020, 13(5): 919-935. LU D X, FANG W H, LI Y Y, et al. Optical coherence tomography: Principles and recent developments[J]. Chinese Optics, 2020, 13(5): 919-935(in Chinese). [47] 王丽雯, 崔林, 邹吉新, 等. OCTA在视网膜静脉阻塞诊疗中的应用价值[J]. 国际眼科杂志, 2019, 19(8): 1361-1364. WANG L W, CUI L, ZOU J X, et al. Application value of OCTA examination in diagnosis and treatment of retinal vein occlusion[J]. International Eye Science, 2019, 19(8): 1361-1364(in Chinese). [48] 仲妍, 车慧欣. 光学相干断层扫描血管成像(OCTA)在原发性青光眼患者中的检测价值[J]. 眼科新进展, 2018, 38(4): 352-356. ZHONG Y, CHE H X. Detective values of optical coherence tomography angiography for primary glaucoma[J]. Recent Advances in Ophthalmology, 2018, 38(4): 352-356(in Chinese). [49] SAKAI J, MINAMIDE K J, NAKAMURA S, et al. Retinal arteriole pulse waveform analysis using a fully-automated Doppler optical coherence tomography flowmeter: A pilot study[J]. Translational Vision Science & Technology, 2019, 8(3): 13. [50] KISELEVA E, RYABKOV M, BALEEV M, et al. Prospects of intraoperative multimodal OCT application in patients with acute mesenteric ischemia[J]. Diagnostics, 2021, 11(4): 705. doi: 10.3390/diagnostics11040705 [51] 韦赢兆, 袁钘, 蓝公仆, 等. 心血管光学相干层析成像的研究进展和应用[J]. 激光与光电子学进展, 2021, 58(24): 2400002. WEI Y Zh, YUAN Q, LAN G P, et al. Research progress and application of cardiovascular optical coherence tomography[J]. Laser & Optoelectronics Progress, 2021, 58(24): 2400002(in Chinese). [52] 朱梦琪, 张敏燕, 徐康, 等. 光声血流速度测量方法及研究进展[J]. 光学仪器, 2021, 43(1): 88-94. ZHU M Q, ZHANG M Y, XU K, et al. The methods and research progress of photoacoustic blood flow velocity measurement[J]. Optical Instruments, 2021, 43(1): 88-94(in Chinese). [53] GIFANI M, EDDINS D J, KOSUGE H, et al. Ultraselective carbon nanotubes for photoacoustic imaging of inflamed atherosclerotic plaques[J]. Advanced Functional Materials, 2021, 31(37): 2101005. doi: 10.1002/adfm.202101005 [54] AMIDI E, YANG G, UDDIN K M S, et al. Role of blood oxygenation saturation in ovarian cancer diagnosis using multi-spectral photoacoustic tomography[J]. Journal of Biophotonics, 2020, 14(4): e202000368. [55] 尹荣贻, 仝雨, 赵友全, 等. 光学多普勒血液微循环测量技术及其最新进展[J]. 光学技术, 2013, 39(2): 112-123. YIN R Y, TONG Y, ZHAO Y Q, et al. Optical Doppler technologies for micro-circulation measurement and their recent progress[J]. Optical Technique, 2013, 39(2): 112-123(in Chinese). [56] BELL A G. Upon the production and reproduction of sound by light[J]. American Journal of Society, 1880, S3-20(118): 305-324. [57] SHEINFELD A, GILEAD S, EYAL A. Photoacoustic Doppler measurement of flow using tone burst excitation[J]. Optics Express, 2010, 18(5): 4212-4221. [58] 黄珊珊, 聂立铭. 光声成像在生物医学研究中的应用进展[J]. 厦门大学学报(自然科学版), 2019, 58(5): 625-636. HUANG Sh Sh, NIE L M. Recent progresses of photoacoustic imaging in biomedical applications[J]. Journal of Xiamen University(Natural Science Edition), 2019, 58(5): 625-636(in Chinese). [59] VALLURU K S, WILLMANN J K. Clinical photoacoustic imaging of cancer[J]. Ultrasonography, 2016, 35(4): 267-280. [60] MIAO Q Q, LYU Y, DING D, et al. Semiconducting oligomer nanoparticles as an activatable photoacoustic probe with amplified brightness for in vivo imaging of pH[J]. Advanced Materials, 2016, 28(19): 3662-3670. [61] DENG H, SHANG W, LU G, et al. Targeted and multifunctional technology for identification between hepatocellular carcinoma and liver cirrhosis[J]. ACS Applied Materials & Interfaces, 2019, 11(16): 14526-14537. [62] 张建英, 谢文明, 曾志平, 等. 光声成像技术的最新进展[J]. 中国光学, 2011, 4(2): 111-117. ZHANG J Y, XIE W M, ZENG Zh P, et al. Recent progress in photoacoustic imaging technology[J]. Chinese Optics, 2011, 4(2): 111-117(in Chinese). [63] 乔伟, 陈重江. 基于光学相干检测的非接触式光声多普勒流速仪[J]. 激光生物学报, 2018, 27(4): 338-344. QIAO W, CHEN Ch J. Noncontact photoacoustic Doppler flowmetry based on optical coherent detection[J]. Acta Laser Biology Sinica, 2018, 27(4): 338-344(in Chinese). [64] 杨晨. 高性能光声成像技术研究[D]. 合肥: 中国科学技术大学, 2021: 62-88. YANG Ch. Photoacoustic lmaging with enhanced sensitivity, resolution and speed[D]. Hefei: University of Science and Technology of China, 2021: 62-88(in Chinese). [65] 巩飞, 程亮, 刘庄. 基于纳米探针的肿瘤光声成像研究[J]. 激光与光电子学进展, 2020, 57(18): 180004. GONG F, CHENG L, LIU Zh. Application of nanoprobes in photoacoustic cancer imaging[J]. Laser & Optoelectronics Progress, 2020, 57(18): 180004. [66] 林日强, 冷吉, 陈敬钦, 等. 面向临床应用的光声成像技术[J]. 中国医疗设备, 2018, 33(1): 1-5. LIN R Q, LENG J, CHEN J Q, et al. Photoacoustic lmaging technology for clinical applications[J]. China Medical Devices, 2018, 33(1): 1-5(in Chinese). [67] VENKATESH R, JAYADEV C, SRIDHARAN A, et al. Internal limiting membrane detachment in acute central retinal artery occlusion: A novel prognostic sign seen on OCT[J]. International Journal of Retina and Vitreous, 2021, 7(1): 51. [68] ZHANG H F, PULIAFITO C A, JIAO Sh L. Photoacoustic ophthalmoscopy for in vivo retinal imaging: Current status and prospects[J]. Ophthalmic Surgery, Lasers & Imaging, 2011, 42(s0): 106-115. [69] 宋伟. 视网膜组织光学吸收特性的光致超声成像研究[D]. 哈尔滨: 哈尔滨工业大学, 2014: 73-102. SONG W. Investigation of photoacousticimaging on optical absorption property of retina[D]. Harbin: Harbin Institute of Technology, 2014: 73-102(in Chinese). [70] 齐伟智. 应用于早期口腔癌的光学分辨率光声显微成像系统[D]. 成都: 电子科技大学, 2018: 53-62. QI W Zh. Optical-resolution photoacoustic microscopy for early-stage oral cancer detection[D]. Chengdu: University of Electronic Science and Technology of China, 2018: 53-62(in Chinese). [71] DENIZ E, MISEMILY K, LANE M, et al. CRISPR/Cas9 F0 screening of congenital heart disease genes in xenopus tropicalis. [J]. Methods in Molecular Biology, 2018, 1865: 163-174. [72] 王龙, 金保哲, 张新中. 脑血流监测对大鼠脑缺血模型制备的评价作用[J]. 中国脑血管病杂志, 2017, 14(5): 254-260. WANG L, JIN B Zh, ZHANG X Zh. Effects of the monitoring of cerebral blood flow in the preparation of cerebral ischemia model in rats[J]. Chinese Journal of Cerebrovascular Diseases, 2017, 14(5): 254-260(in Chinese). [73] ZHANG Zh, TANG W W, LI Y F, et al. Bioinspired conjugated tri-porphyrin-based intracellular ph-sensitive metallo-supramolecular nanoparticles for near-infrared photoacoustic imaging-guided chemo-and photothermal combined therapy[J]. ACS Biomaterials Science & Engineering, 2021, 7(9): 4503-4508. [74] WANG Y M, BOWER B A, IZATT J A, et al. In vivo total retinal blood flow measurement by Fourier domain Doppler optical coherence tomography[J]. Journal of Biomedical Optics, 2007, 12(4): 041215. [75] 潘柳华, 张向阳, 李中梁, 等. 基于光声-光学相干层析成像的血流测量技术[J]. 中国激光, 2018, 45(6): 0607004. PAN L H, ZHANG X Y, LI Zh L, et al. Blood flow measurementwith photoacoustic microscopy and optical coherence tomography[J]. Chinese Journal of Lasers, 2018, 45(6): 0607004(in Chinese). [76] SABIONI L, de LORENZO A, LAMAS C, et al. Systemic microvascular endothelial dysfunction and disease severity in COVID-19 patients: Evaluation by laser Doppler perfusion monitoring and cytokine/chemokine analysis[J]. Microvascular Research, 2021, 134: 104119. -

 网站地图
网站地图


 下载:
下载: