HTML
-
糖尿病是一种严重危害患者身体健康,并且会引起眼疾、心血管疾病等多种并发症的慢性疾病[1]。目前,医学上并没有能够根除糖尿病的治疗方法[2],在临床和家庭中,患者需要在一定时间内多次的扎破手指进行采血得到血糖浓度[3],这种有创的血糖监测方法存在许多缺点,例如若处理不当可能会造成感染而且会对患者产生较大的心理压力,并且此种方法无法实现对血糖在一段时间内的连续监测。因此,光学无创血糖测量是一种理想的血糖检测方式,光学检测方法便捷、无损,对人体没有伤害,存在巨大优势。目前,已经有许多科研团队和公司在研究光学测量血糖的方法和仪器[4],常见的光学血糖检测方法有光学相干层析成像法[5-8]、近红外光谱法[9-13]、喇曼光谱法[14-17]。
光学相干层析(optical coherence tomography,OCT)是一种基于低相干干涉的新兴技术,能够对待测样品进行无损层析扫描,从而实现3维成像。人体皮肤可简单分成角质层、表皮层、真皮层和皮下组织[18]。其中,真皮层内部组织散射系数随血糖变化相关性较高[19],原因在于真皮层的乳头层内包含有较多的毛细血管,其中的血液内含有葡萄糖,由于葡萄糖具有渗透特性,葡萄糖会由毛细血管渗透到组织细胞内,导致细胞体积变化,即组织光学特性变化,测得的散射系数就会发生改变。而OCT在光学无创血糖检测中的优势在于:在标定时可以通过计算组织内部不同位置散射系数随血糖的变化情况,找出其散射系数随血糖变化最敏感的区域作为后续预测值计算的区域,从而达到提高无创血糖测量精确度的目的。但是在标定过程中,对OCT采集的3维图像处理算法不同,也会影响最后计算得到的血糖预测值的准确性。
为了解决上述问题,本文作者在团队之前研究的基础上[20-21],就标定过程中对3维图像数据不同处理方法做了对比研究,并提出了一种最优化的处理算法。结果表明,在对采集的3维皮肤图像进行皮肤表面对齐、3维重建、1维平均处理的基础上,再进行去除背景噪声和使用不归一化的OCT数据计算后,血糖预测的标准差比之前分别减小了57.31%和12.66%,取得了更加良好的检测效果。
-
实验中所用的仪器(A-scan)为高速扫频OCT(General Photonics,Inc.SSOCT-1000),光源的中心波长为1310 nm,平均功率小于49.5 mW、大于24 mW,扫描频率为100 kHz。该系统的横向分辨率为20 μm,轴向分辨率为20 μm,灵敏度为105 dB。探头水平面(x×y)最大扫描范围为3 mm×3 mm,最大扫描深度为6 mm。扫描人体皮肤图像时,设置待测区域的扫描大小为1.5 mm×2 mm。
-
实验对象为4名2型糖尿病患者,采取标准的馒头餐实验。每幅OCT 3维图像采集时间间隔为1 min,采集区域为手前臂内侧皮肤,过程中患者前臂保持不动,室内温度稳定在25 ℃。使用泰尔茂血糖仪采集指血值,或使用雅培瞬感血糖仪采集组织间液血糖值与OCT的血糖测量值进行对比。两种血糖仪均是通过电化学法实现血糖检测,其中雅培瞬感血糖仪可以连续监测14 d,每分钟可以采集一个血糖值数据。1号志愿者所用为泰尔茂指尖血糖仪,2号、3号、4号志愿者所用为雅培瞬感血糖仪。
-
葡萄糖是一种具有渗透性的分子,可以在人体内通过血液的流动,渗透到各级细胞中,完成能量的传递。它的渗透会影响细胞组织内的折射率变化,导致散射系数发生改变。目前很多的研究都表明,一定深度的人体皮肤下组织的散射系数和血糖浓度有很好的相关性[21-23],而散射系数是一种光学参量,可以通过OCT测得。
因为真皮层深度区域内毛细血管较多,所以一般会选择皮下大约300 μm~600 μm深度范围的OCT信号进行计算求得散射系数[24-25]。之后,利用偏最小二乘法得到散射系数与血糖值的线性关系式作为标定方程。有了标定方程,后续只需要将对应时刻的OCT测得的散射系数返带入标定方程中,即可算出对应的血糖值。散射系数主要依据OCT图像进行计算,图像处理方式不同,得到的散射系数也会有差异,从而会导致无创血糖测量的不准确。为了解决上述问题,本文作者提出的优化处理方法见下。
(1) 通过OCT采集人体皮肤的图像,一般选择手前臂内侧的皮肤。在患者饭后或用药后的60 min~120 min内,每分钟采集一两幅OCT 3维图像,在此期间通过血糖仪记录5~6个不同时刻的实际血糖数值用于标定计算。由于仪器本身硬件及光路等因素不可避免会产生噪声,因此在定量计算散射系数时会造成影响。所以可以在血糖实验前后,需要空采几幅没有样品(人体皮肤)的图像作为背景噪声的样本。之后在算法中,用实验中每一幅含有皮肤图像的有效的3维数据都减去空采背景噪声的3维数据。目的是为了减小每一幅图像中背景噪声的影响,从而使得预测血糖值更为接近真实值。用数据模型可表示为:
式中,S0(x,y,z)为像素点(x,y,z)处的真正信号值,n(x,y,z)为该点处的噪声信号值,S(x,y,z)为该点处的总信号值。在实验结束后,通过减去空采图像的数据,实现减去噪声的目的,也就是减去噪声信号值n(x,y,z),保留真正信号值。
(2) 为了得到有效的皮肤3维图像(见图 1a),对去除背景噪声的皮肤3维图像数据进行剪切对齐处理(见图 1b),将所有A-scan信号进行平均,即得到沿深度(z)方向的1维平均A-scan信号(见图 1c)。图 1c中,a-b段为表皮层[23]位置,b-c段为真皮层与表皮层交界的位置,c段以下的部分为真皮层[24]的位置。

Figure 1. a—OCT 3-D images of human hand forearm skin b—skin image after surface alignment c—1-D average A-scan signal diagram
剪切对齐操作主要步骤为:首先将采集的皮肤图像转换为二值图像,有皮肤区域的部位为1,皮肤区域边界以外的部分为0,将有皮肤的区域通过创建的矩形结构框勾选出来后,再利用边界寻找算法从各个方向寻找到有效皮肤区域的边界坐标并记录,即可裁切掉边界外的无效区域,最后得到有效皮肤3维图像。因为3维皮肤图像表面并不平整,还需要进行皮肤表面对齐处理(用以保证后续用真皮层区域做标定预测计算的一致性)。通过算法在所有A-scan信号中寻找到皮肤表面的最高点位置,之后将其它A-scan信号的皮肤表面位置拉平对齐到与最高位置平行的坐标,被拉高的A-scan信号下方的空档区域补0,即可得到完整的剪切对齐后的皮肤图像。
在平均的过程中可以进行归一化或者不归一化,处理方式不同得到的散射系数结果也不同。其原因在于归一化主要是通过对数据的缩放,把数据映射到0~1之间去处理,使得数据计算更加方便快捷。但是归一化的过程是由数据中的极值决定的,归一化会缩放数据的变化幅度,数据变化趋势虽然可以保持不变,但对其幅度的缩放会影响散射系数的计算精度,从而导致无创血糖预测的结果的不准确。因此,作者采用的是未归一化的处理方式来计算散射系数。散射系数计算采用单次散射模型[26],模型中使用的OCT信号以对数形式表示[27]为:
式中,μt为样品的散射系数,N(z)为样品在深度z处的光强,N0为入射光强,z为光穿透的深度。OCT信号深度在z处的直线拟合斜率可以表示为:
OCT分辨率为微米量级,散射系数即可表示为:
确定真皮层的深度范围后(一般在300 μm~600 μm段),选择某一深度位置作为起始点,并设置计算步长,分别计算从起始点开始1倍步长、2倍步长⋯⋯N倍步长的散射系数(即不同深度范围的散射系数)。计算不同深度区域散射系数与血糖变化的相关性,即可找到二者的高相关区域用于后续的血糖预测计算,同时还可得到散射系数与血糖值的线性关系式作为标定方程[25]。之后只需要将每幅OCT图像对应深度位置的散射系数求出来,代回标定方程中,即可完成血糖预测值的计算。
1.1. 实验仪器及参数
1.2. 实验设计
1.3. OCT图像处理优化方法
-
由于OCT本身存在噪声,而这部分噪声与仪器本身的器件和光路设计有关,可以将这些噪声称为背景噪声。背景噪声会影响图像质量,并且会影响后续的散射系数计算,最终导致预测结果的不准确。以空采(不采集待测位置图像)作为背景噪声的参考,并在有效图像中减去空采,可以在一定程度上减小背景噪声的影响。
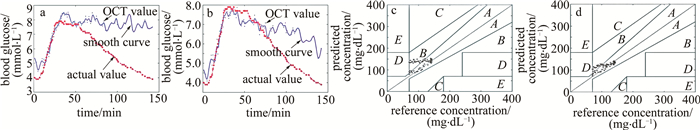
从图 2a中4号志愿者的实验结果可以看出,当有背景噪声的时候,预测血糖曲线的后半段(50 min后)与实际血糖的变化趋势有较大区别,而图 2b中无背景噪声后的预测曲线下降得更快,也更符合实际血糖变化趋势。出现此现象的原因主要在于数据处理方法是在3维空间范围减去背景噪声,即将有效图像的3维矩阵减去背景噪声的3维矩阵。皮肤内部不同深度区域的光强值因减去噪声的缘故,变化也各不相同。而用于计算预测血糖值的平均散射系数是基于真皮层内不同深度区域的散射系数得到。将3维图像平均成1维OCT信号后,由于去除背景噪声的原因,其不同深度区域因血糖变化引起的有效光强信号占比得到了提升,因此计算得到的平均散射系数变化趋势与血糖变化也更趋于相近。将平均散射系数代入标定拟合公式后得出的预测血糖值则更接近于真实血糖变化的情况。

Figure 2. Blood glucose change curve and Clark error analysis diagram with or without background noise
图 2中的红色虚线表示实际血糖的变化曲线,蓝色实线表示由OCT预测的平滑后的血糖变化曲线,蓝色的点表示对应时刻OCT预测的血糖值。有背景噪声和无背景噪声时的预测血糖值与真实血糖值的差值均值±标准差分别为1.18 mmol/L±1.06 mmol/L和0.68 mmol/L±0.59 mmol/L,两种情况下的预测和实际血糖变化曲线的整体相关性分别为R=0.53,R=0.80。
图 2c和图 2d分别为有背景噪声和无背景噪声时的血糖预测的克拉克误差分析结果。图 2c中有57.15%的结果落在A区域,42.85%的结果落在了B区域。图 2d中有75%的结果落在了A区域,25%的结果落在了B区域,说明无背景噪声后的血糖预测结果更为准确。
表 1中列出了4位志愿者有无背景噪声后的预测血糖曲线与实际血糖曲线之间的整体相关性大小、两种计算方法下血糖预测值与实际值之间的差值均值±标准差的大小以及克拉克误差分析结果。预测值与实际值之间的差值均值±标准差的大小表示两曲线间的每个数值之间的偏差和离散程度。克拉克误差分析则是血糖预测方面准确性的标准,A区域的准确性最高,与实际血糖值相差±20%,B区域为40%,在临床实验中为可接受范围,但是C,D,E区域的预测结果较差,不能在临床上为医生提供参考,所以A区域的占比越高越好。
volunteer overall correlation R mean of difference±standard deviation/(mmol·L-1) Clarke analysis area proportion/% with background noise without background noise with background noise without background noise with background noise without background noise 1 0.63 0.91 0.97±0.70 0.25±0.18 A:78
B:22A: 100 2 0.31 0.82 1.03±0.66 0.41±0.39 A:67.5
B:32.5A:95
B:53 0.69 0.73 0.75±0.85 0.53±0.23 A:84.61
B:15.39A:100 4 0.53 0.80 1.18±1.06 0.68±0.59 A:57.15
B:42.85A:75
B:25average value 0.54 0.82 0.98±0.82 0.47±0.35 A:71.82
B:28.18A:92.5
B:7.5Table 1. Comparison of blood glucose parameters of four volunteers with or without background noise
从表 1中可以看出,背景噪声对血糖预测的结果有很大影响,而减去背景噪声在一定程度上提升血糖预测结果的精度。4位志愿者的实验结果中无背景噪声时预测血糖曲线与实际血糖变化曲线的整体相关性都要优于有背景噪声时的结果,整体相关性R更接近于1,提升了约50.94%。而测量值标准差也比之前有背景噪声时要小,减小了约为57.31%。克拉克误差分析结果在有背景噪声时A区域平均占比71.82%,B区域平均占比28.18%,无背景噪声时A区域平均占比92.5%,B区域平均占比7.5%。
-
在血糖预测的过程中,首先通过对采集的图像进行深度方向上的平均,得到沿深度方向变化的1维OCT信号,而很多时候对OCT信号进行归一化后发现预测结果并不准确,可能是由于归一化造成了散射系数的变化幅度缩放和归一化使得散射系数的计算精度降低导致了这种情况。接下来通过对4位糖尿病患者的实验结果对此影响进行验证。图 3a表示将OCT 3维图像中所有A-scan信号进行平均,得到归一化后沿深度方向的1维信号光强图,皮肤表面最大值是1。图 3b为未归一化的沿深度方向的1维信号光强图。
如图 3所示,对于OCT 1维光强信号,其归一化的数据会受到该组数据中极值点的影响,而极值点通常在皮肤表面的位置,如图 3a中a点所示。以a点为最大值对整组数据进行归一化操作,则该组数据的比例缩放变化均会由a点光强值所决定,而后续散射系数的计算直接取决于该组数据变化的情况。若前后不同时间点的图像受到外界因素干扰,使得各自生成的OCT 1维光强信号在a点的光强值不同,则由此会导致计算得到的散射系数变化受到影响,最终造成血糖预测结果的不准确。对于不归一化的数据,即使极值点光强有波动,其在皮肤不同位置的1维光强信号也不会受到影响,从而计算得到的散射系数能够更好地反映血糖的变化趋势,预测结果也会更为准确。
图 4a为1号志愿者归一化条件下预测血糖曲线与实际血糖曲线,图 4b为不归一化条件下预测血糖曲线与实际血糖曲线。图中的红色虚线表示实际血糖的变化曲线,蓝色实线表示由OCT预测的平滑血糖曲线,蓝色的点表示对应时刻OCT预测的血糖值。两条曲线的整体相关性分别为R=0.55和R=0.61,差值均值±标准差分别为0.81 mmol/L±0.54 mmol/L和0.71 mmol/L±0.52 mmol/L。可以看出,不归一化的OCT信号在血糖预测的结果更为准确,这是因为没有归一化的信号的变化幅度会更接近于实际血糖的变化幅度。图 4c和图 4d分别为归一化和不归一化条件下的血糖预测的克拉克误差分析结果,两图的预测结果均100%落于A区域。

Figure 4. Blood glucose change curve and Clarke error analysis diagram under normalization and non-normalization
表 2中列出了4位志愿者的预测血糖曲线和实际血糖曲线在是否归一化后的两曲线之间的整体相关性大小、两种处理方法下预测值与实际值之间的差值均值±标准差的大小和克拉克误差分析。从表中可以看出,4位志愿者的实验结果中由不归一化的OCT信号处理得到的预测血糖曲线更接近于实际血糖变化曲线,其整体相关性比归一化时提升了约11.33%,标准差减小了12.66%。克拉克分析的结果归一化时A区域平均占比87.27%,B区域平均占比12.73%,不归一化时A区域平均占比93.15%,B区域平均占比6.85%。能够看出不归一化处理得到的结果整体是优于归一化处理时的结果的,说明这种方法能够提高无创血糖的预测精度。
volunteer overall correlation R mean of difference±standard deviation/(mmol·L-1) Clarke analysis area proportion/% normalized nonnormalized normalized nonnormalized normalized nonnormalized 1 0.73 0.74 0.53±0.23 0.29±0.21 A: 83.33
B: 16.67A: 92.85
B: 7.152 0.80 0.85 0.68±0.59 0.65±0.50 A: 75
B: 25A: 79.76
B: 20.233 0.55 0.61 0.81±0.54 0.71±0.52 A: 100 A: 100 4 0.58 0.77 0.97±0.67 0.67±0.54 A: 90.75
B: 9.25A: 100 average value 0.67 0.74 0.71±0.51 0.58±0.44 A: 87.27
B: 12.73A: 93.15
B: 6.85Table 2. Comparison of blood glucose related parameters of 4 volunteers under normalization and non-normalization
2.1. 背景噪声对血糖预测精度的影响
2.2. OCT信号是否归一化对血糖预测的影响
-
光学相干层析技术在无创血糖检测方面具有很好的发展前景。但在通过OCT图像采集进行无创血糖检测过程中,其图像算法处理尚存在较多需要改进的方面。本文中基于4名2型糖尿病患者的临床血糖实验结果,主要研究了背景噪声以及获取OCT信号是否归一化对血糖预测精度的影响,并提出了相应的最优化处理方法。分析结果表明,依据本文中的方法处理后得到的无创血糖测量结果的平均测量误差减小了18.31%,预测血糖曲线与实际血糖变化曲线整体相关性提高了11.33%。该研究对于提高光学无创血糖测量精度具有重要的参考价值。

 Map
Map



 DownLoad:
DownLoad: